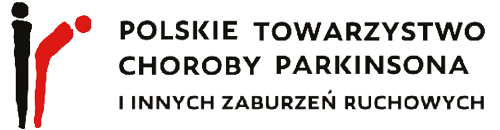Autor: Krzysztof Duda,
Uniwersyteckie Centrum Kliniczne im. K. Gibińskiego w Katowicach
Wstęp
Aceruloplazminemia jest bardzo rzadką chorobą genetyczną z grupy schorzeń neurodegeneracyjnych spowodowanych nadmiernym gromadzeniem żelaza w obrębie ośrodkowego układu nerwowego (NBIA).
Jest związana z biallelicznymi mutacjami w obrębie genu CP zlokalizowanym
na chromosomie 3q24-q25, który składa się z 20 eksonów i koduje białko ceruloplazminę (Cp).
Ceruloplazmina nie tylko transportuje jony miedzi w surowicy krwi, ale również bierze udział, wraz z ferrooksydazą w utlenianiu żelaza dwuwartościowego do trójwartościowego.
Jej całkowity brak w ustroju powoduje stopniowe spichrzanie żelaza w obrębie narządów osoby chorej.
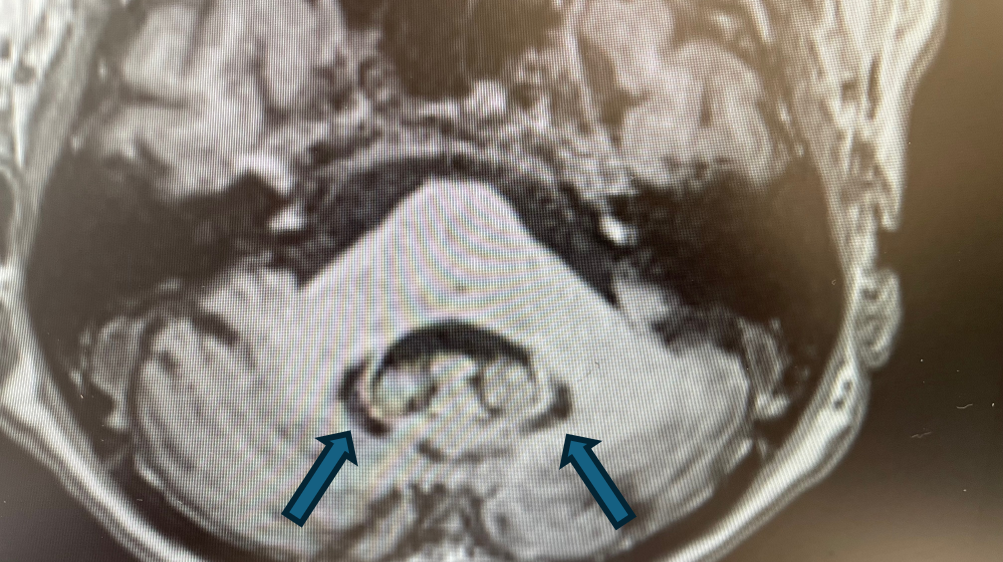
W obrębie OUN cechy akumulacji żelaza stwierdza się typowo w obrębie gałek bladych, prążkowia, jądra ogoniastego, wzgórz, kory mózgowej, a także w obrębie jąder zębatych móżdżku. Rzadziej może dochodzić do akumulacji w obrębie hipokampów i splotu naczyniówkowego, a także do występowania uogólnionych zmian zanikowych kory mózgowej.
Występuje głównie w wieku dorosłym, do jej charakterystycznych objawów należy triada obejmująca cukrzycę, zwyrodnienie barwnikowe siatkówki i deficyty neurologiczne takie
jak ataksja, objawy pozapiramidowe, zaburzenia funkcji poznawczych i ruchy mimowolne głównie w postaci mimowolnych ruchów oromandibularnych twarzy. U chorych wyróżnia
się zaburzenia biochemiczne i hematologiczne pod postacią anemii mikrocytarnej z wysokim stężeniem ferrytyny, obniżoną saturację transferryny we krwi (TfS), a także obniżone stężenie miedzi we krwi, dobowej zbiórce moczu i nieoznaczalne stężenie ceruloplazminy w surowicy.
W przeciwieństwie do choroby Wilsona, w której bardzo często obserwuje się wtórne do akumulacji miedzi objawy uszkodzenia wątroby w postaci marskości, zwłóknienia czy niewydolności tego narządu, w aceruloplazminemii — mimo znacznego odkładania się żelaza w hepatocytach (zwykle > 1200 μg/g suchej tkanki) — bardzo rzadko dochodzi do marskości czy niewydolności wątroby.
Opis przypadku
61-letnia pacjentka została skierowana do Kliniki Jednego Dnia Oddziału Neurologii UCK z powodu stwierdzenia nasilonych zaburzeń funkcji poznawczych (MMSE 13 pkt) i nieprawidłowego wyniku badania obrazowego.
Na podstawie wywiadu uzyskanego od pacjentki i opiekuna stwierdzono postępujące
od około 2 lat zaburzenia pamięci świeżej ze stopniowym pogarszaniem się zdolności do codziennego funkcjonowania.
Ponadto u chorej rok wcześniej de novo zdiagnozowano cukrzycę insulinozależną. Od około 2 lat córka pacjentki zauważyła występowanie mimowolnych ruchów oromandibularnych, a także zaburzenia równowagi o niewielkim nasileniu bez współistniejących upadków.
Pacjentka nie przyjmowała w przeszłości leków neuroleptycznych. Wywiad rodzinny był obciążony chorobą otępienną u mamy pacjentki, u której również u schyłku życia występowały ruchy oromandibularne twarzy.
W wykonanym przed przyjęciem MR głowy z kontrastem stwierdzono zmiany wsteczne, a także cechy akumulacji jonów metali w obrębie jąder podstawnych, wzgórz, hipokampów, jąder czerwiennych i jąder zębatych móżdżku opisane jako podejrzenie choroby ze spektrum NBIA.
W badaniu neurologicznym stwierdzono zespół otępienny z współistniejącym zespołem hiperkinetyczno-ataktycznym na który składały się: dyzartryczna mowa, dyskinezy oromandibularne, czterokończynowo spowolnienie ruchów precyzyjnych, dyskretna czterokończynowa ataksja. Chód pacjentki był samodzielny, na nieznacznie poszerzonej podstawie, chód tandemowy był zaburzony.
W badaniu przesiewowym wykonanym podczas hospitalizacji stwierdzono wynik z pogranicza umiarkowanego i głębokiego zespołu otępiennego o typie amnestycznym. (ACE 42/100 pkt, MMSE 15 pkt.) W badaniach laboratoryjnych stwierdzono prawidłowe parametry morfologii krwi, kreatyniny jonogramu i parametrów wątrobowych, prawidłowe TSH, fT4 i prawidłowy lipidogram.
W otrzymanych po wypisie badaniach stwierdzono nieoznaczalny poziom ceruloplazminy, znacznie obniżony poziom miedzi, a także obniżony poziom żelaza i znacznie podwyższone stężenie Ferrytyny we krwi.
Wnioski
Na podstawie obrazu klinicznego i badań dodatkowych wysunięto podejrzenie aceruloplazminemii i skierowano pacjentkę na badanie genetyczne celem wykrycia mutacji w genie CP – obecnie pacjentka oczekuje na wykonanie badania genetycznego.
Skierowano pacjentkę ponadto na konsultację okulistyczną celem oceny pod kątem występowania zwyrodnienia barwnikowego siatkówki.
Leczenie aceruloplazminemii obejmuje leki chelatujące żelazo (Deferoksamina/Deferazyroks), witaminę E, a także dietę dietę z ograniczeniem żelaza
i witaminy C.
Jako objawowe leczenie dyskinez oromandibularnych można zastosować tetrabenazynę, głównym ograniczeniem jej stosowania jest jednak brak refundacji w tej jednostce chorobowej i bardzo wysoki koszt terapii.
Wymagana jest dalsza diagnostyka i stała opieka w ramach Poradni Okulistycznej (zwyrodnienie barwnikowe siatkówki), Hepatologicznej (ryzyko uszkodzenia wątroby), Diabetologicznej (cukrzyca) i Hematologicznej (ryzyko wystąpienia niedokrwistości).
Aceruloplazminemię powinniśmy podejrzewać w przypadku wystąpienia cukrzycy insulinozależnej w wieku dorosłym z towarzyszącą niedokrwistością i/lub zaburzeniami neurologicznymi pod postacią zaburzeń funkcji poznawczych, zaburzeń pozapiramidowych i ataksji. W tym wypadku przesiewowe wykonanie badania poziomu ceruloplazminy i miedzi we krwi może pomóc naprowadzić lekarza na właściwą diagnozę.
Rycina 1. Cechy akumulacji jonów żelaza w obrębie jąder podkorowych. (T1)
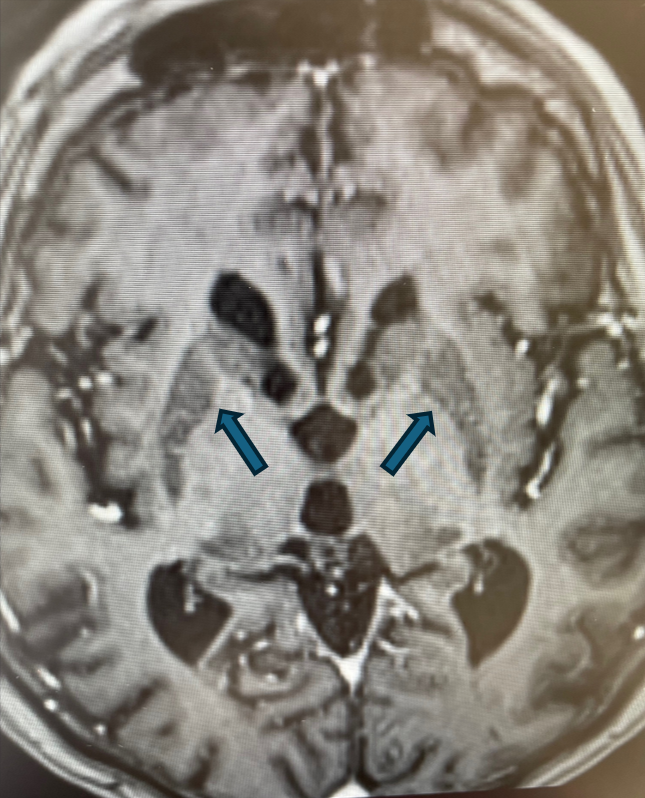
Rycina 2. Cechy akumulacji jonów żelaza w obrębie jąder podkorowych. (SWI).
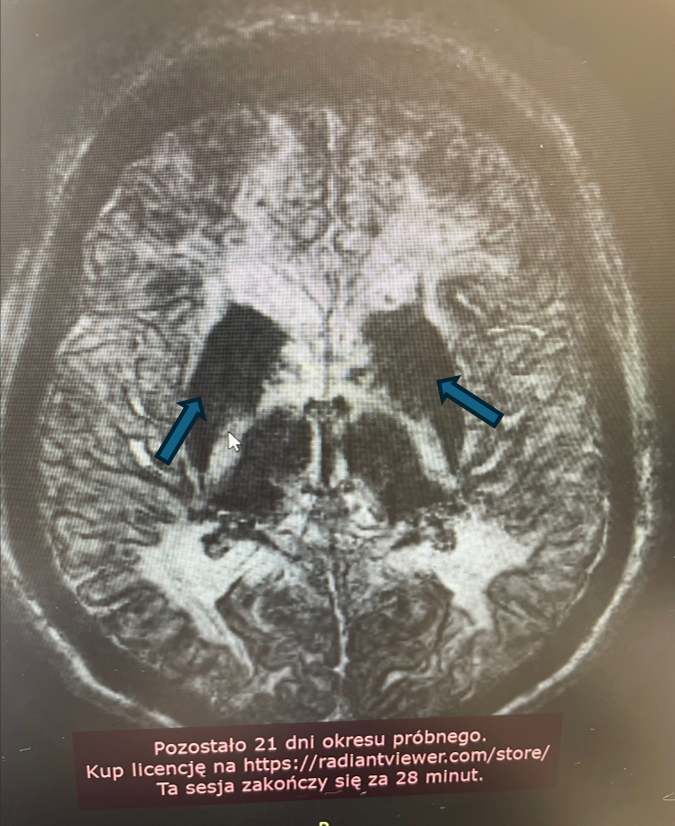
Rycina 3. Cechy akumulacji jonów żelaza w obrębie jąder czerwiennych. (T1).
Rycina 4. Cechy akumulacji jonów żelaza w obrębie jąder zębatych móżdżku (T1).
Video 1. Dyzartria. Dyskinezy oromandibularne.
Video 2. Spowolnienie ruchów precyzyjnych i naprzemiennych kończyn górnych. Ruchy oromandibularne.
Video 3. Spowolnienie ruchów precyzyjnych kończyn dolnych.
Video 4. Drżenie pozycyjne i zamiarowe, dysmetria w kończynach górnych.
Video 5. Chód na nieznacznie poszerzonej podstawie z zachwianiami równowagi
Video 6. Zaburzony chód tandemowy
Tabela 1. Diagnostyka różnicowa schorzeń neurozwyrodnieniowych przebiegających z akumulacją metali w ośrodkowym układzie nerwowym na podstawie badania rezonansu magnetycznego i tomografii komputerowej OUN (za Antos A. i wsp.)
|
Metal |
Zmiany w obrazowaniu |
||
|
MRI T1 |
MRI T2 |
CT |
|
|
Ca2+ |
hipointensywne/ /hiperintensywne |
hipointensywne |
hiperdynsyjne |
|
Fe3+ |
hipointensywne/ /izointensywne |
hipointensywne |
izodensyjne |
|
Mn2+ |
hiperintensywne |
izointensywne |
- |
|
Cu2+ |
izointensywne/ hiperintensywne |
hipointensywne/ hiperintensywne |
- |
T1 – sekwencja T1-zależna; T2 – sekwencja T2-zależna; Ca – wapń, Fe – żelazo; Mn – mangan; Cu - miedź
Biblografia:
1. Antos A, Litwin T, Przybyłkowski A, Skowrońska M, Kurkowska-Jastrzębska I, Członkowska A. Aceruloplazminemia. Polski Przegląd Neurologiczny. 2021;17(4):185–191. doi:10.5603/PPN.2021.0032.
2. Marchi G, Busti F, Lira Zidanes A, Castagna A, Girelli D. Aceruloplasminemia: A Severe Neurodegenerative Disorder Deserving an Early Diagnosis. Front Neurosci. 2019 Apr 5;13:325. doi: 10.3389/fnins.2019.00325. PMID: 31024241; PMCID: PMC6460567.
3. Lobbes H, Reynaud Q, Mainbourg S, Lega JC, Durieu I, Durupt S. L'acéruléoplasminémie héréditaire, une pathologie à ne pas méconnaître [Aceruloplasminemia, a rare condition not to be overlooked]. Rev Med Interne. 2020 Nov;41(11):769-775. French. doi: 10.1016/j.revmed.2020.06.002. Epub 2020 Jul 16. PMID: 32682623.